免洗免灭包装无菌性的验证和维护
确保无菌性是了解灭菌过程设计及其影响的关键。必须认识到,无菌性更多的是一种概率,而不是一个绝对值。也就是说,微生物在灭菌后的物体上面存活的可能性有多大,以及这个保证对于该“产品”有什么影响,例如残留消毒剂的危险程度和/或对包装材料的有害影响。
无菌性的定义
无菌性通过无菌保证水平(SAL)来量化,该水平表示产品已经被灭菌。例如,SAL 为 10-6是美国食品及药物管理局根据“过度”方法的定义对医疗器械和注射剂所要求的水平。根据美国药典,“过度”灭菌可以定义为:杀灭高浓度的抵抗性微生物可确保杀灭例行加工过程中符合合理预期的生物负载。” “无菌”组件制造商有责任监测并追踪生物负载的变化。
测定SAL 时,首先利用高浓度抵抗性生物体对灭菌循环进行压力测试,然后确定灭菌后存活的菌落形成单位(CFU)的数量。在一个不受控的过程中,产品上 CFU 的性质和数量对灭菌循环而言通常有很大差异。通过监测产品预灭菌后的生物负载水平和分离菌(生物体 ID)的种类可以确定这个差异,从而确定对灭菌方式的固有阻力。两种材料紧密配合在一起的匹配表面(例如针头护罩和针头座)和小腔体(狭窄的通道,例如小孔针头的内部)都是重大挑战,很难“证实”消毒剂在这种难以到达的地方成功杀灭生物负载。
高生物负载的后果
如果监测和变化分析程序确定“产品”的生物负载水平高、生物负载变化大或者抵抗性很强,法规就要求制造商解决上游过程的问题,例如清洁程序、清洁频率、包装材料的微生物清洁度、装配过程以及灭菌剂的选择和轮换。如果无法控制生物负载,可能需要调整灭菌循环以减小额外风险。在灭菌条件的作用下,固有的生物负载会被逐渐杀灭,存活的生物体数量会减少,最佳情况下会完全消除。在适当的条件(温度、压力、湿度、时间和气体浓度)下经过一段时间后,存活概率将达到 10-6 芽孢下降值,这表明单个活生物体在灭菌循环后存活的几率非常低。

在每个循环中,每个托盘上都放置了外部过程挑战装置(EPCD),装置中含有经认证的生物指示剂(BI),其中包含超过 1x106 个高度抵抗性的细菌内生孢子(通过群落验证测试对每一批进行了验证)。灭菌循环后,生物指示剂被移除并转移到一个促进生长的培养基中。培养后如果没有细菌生长,就可以确信灭菌循环达到了所需的 SAL。再加上对灭菌循环处理记录的参数审查,我们可以确信已根据经过验证的参数成功执行了灭菌循环。
注意:生物指示剂有不同的 SAL 浓度,用不同的生物体制备,具有不同的固有阻力,用以挑战不同的灭菌方式(加热、蒸汽、环氧乙烷、电子束、VHP、H2O2 和伽马射线)。
通过使用经验证的流程和适当设计的初级和次级包装,无菌组件将在整个价值链中保持无菌状态。
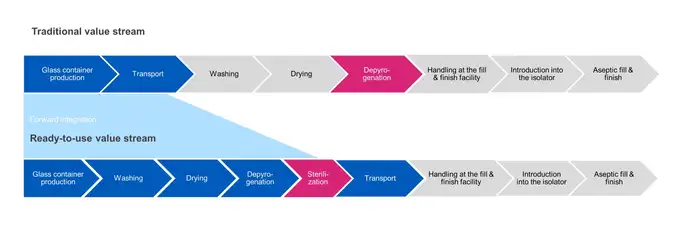
在传统的散装灌装中,在除热原步骤中对容器进行灭菌。产品首先进行清洗、干燥,然后通过隧道烘箱,在高温(280-350 °C)下除热原,以确保产品无菌,然后再直接转移到灌装过程。
与此相反,免洗免灭容器是在最终包装之后、运输到无菌灌装和封装设备之前进行灭菌。在后续加工步骤中,外包装被移除,密封的内包装被无菌转移到灌装过程中。从离开灭菌室这一刻起到进入无菌隔离器,确保这段过程保持无菌有很多挑战。
简而言之,无菌性是一种概率,必须通过经过验证的灭菌过程和合格的包装解决方案最大限度降低物体上生物体存活的风险。对于免洗免灭包装,必须从灭菌这一刻开始直到进入无菌隔离器始终确保无菌。
接下来的几周,我们将详细介绍如何防止污染,确保免洗免灭初级包装从端到端的无菌性。

Dr. Robert Lindner
Product Manager Bulk & Sterile Solutions
注册获取最新消息
注册接收我们的实时通讯,随时了解肖特医药产品和服务的最新信息。