Validação e manutenção da esterilização de embalagens RTU
Garantir a esterilidade é fundamental para compreender o design dos processos de esterilização e seu impacto. É importante perceber que esterilidade refere-se a probabilidades e não valores absolutos. Significando quão grande é a probabilidade de um objeto esterilizado possuir organismos sobreviventes e quais são as consequências para o "produto" como resultado dessa garantia, por exemplo, níveis perigosos de resíduos de esterilizante e/ou efeitos prejudiciais sobre os materiais da embalagem.
A definição de esterilidade
A esterilidade é quantificada pelo nível de garantia de esterilização (NGE), que indica que um produto foi fornecido estéril. Um NGE de 10- 6, por exemplo, é o maior nível de segurança de esterilidade, requerido pelo FDA dos EUA para produtos médicos e injetáveis (sob a definição de uma abordagem de "sobremorte"). De acordo com a USP, a esterilização por "sobremorte" pode ser definida como um método no qual a destruição de uma alta concentração de um micro-organismo resistente suporta a destruição de carga microbiana razoavelmente prevista presente no processamento de rotina." É de responsabilidade do fabricante de componentes "estéreis" monitorar e determinar a carga microbiana.
O NGE é determinado desafiando o ciclo de esterilização com altos níveis de organismos resistentes quantificando o número de unidades formadoras de colônias (UFCs) sobreviventes após a esterilização. A partir de um processo não controlado, geralmente há uma grande variação na natureza e no número de UFCs no produto, conforme submetido ao ciclo de esterilização. A variação é determinada pelo monitoramento da pré-esterilização do(s) produto(s) quanto aos níveis de carga microbiana e especiação dos isolados (ID do organismo) para determinar a resistência inerente à modalidade de esterilização. Superfícies casadas, nas quais dois materiais se encaixam firmemente (como o protetor de agulha e o conector da seringa), e lúmens pequenos (passagens estreitas, como o interior de uma agulha de orifício pequeno), representam desafios significativos para "demonstrar" que o esterilizante matará com sucesso a carga microbiana nesses locais de difícil acesso.
As consequências da alta carga microbiana
Se os programas de monitoramento e tendência determinarem que o "produto" contém altos níveis de carga microbiana, altos níveis de variação de carga microbiana ou altos níveis de resistência, os regulamentos exigem que os fabricantes abordem os processos a montante, por exemplo. programas de limpeza, frequência de limpeza, limpeza microbiológica dos materiais da embalagem, processos de montagem, além da seleção e rotação de agentes antimicrobianos. Se a carga microbiana não estiver sob controle, o ciclo de esterilização poderá precisar ser ajustado para mitigar o risco adicional. Conforme ele for submetido a condições de esterilização, a carga microbiana inerente será gradualmente eliminada e o número de organismos sobreviventes será reduzido e, preferivelmente, eliminado. Depois de um determinado período e sob as condições corretas (temperatura, pressão, umidade, tempo e concentração de gás), a probabilidade de sobreviventes atingirá uma redução de 10a 6 esporos, o que significa que há uma chance incrivelmente baixa de que um único organismo viável sobreviva ao ciclo de esterilização.

Dispositivos de Desafio de Processo Externo (EPCDs) contendo Indicadores Biológicos (BI) certificados que contêm >1x106 endosporos bacterianos altamente resistentes (verificados para cada lote por teste de verificação populacional) são colocados em cada palete em cada ciclo. Após o ciclo, os indicadores biológicos são removidos e transferidos para um meio promotor de crescimento. Após a incubação, se não houver crescimento presente, você pode ter certeza de que o ciclo de esterilização atingiu o NGE necessário. Isso, juntamente com a revisão paramétrica do registro de processamento do ciclo, fornece a garantia de que o ciclo de esterilização foi executado com sucesso de acordo com parâmetros validados.
Observação: Indicadores biológicos estão disponíveis em diferentes concentrações de NGE, preparadas a partir de diferentes organismos, com diferentes resistências inerentes, para desafiar diferentes modalidades de esterilização (calor, vapor, EtO, feixe eletrônico, VHP, H2O2, e Gama).
Um componente estéril manterá a esterilidade ao longo da cadeia de valor por meio de processos validados e embalagem primária e secundária adequadamente projetada.
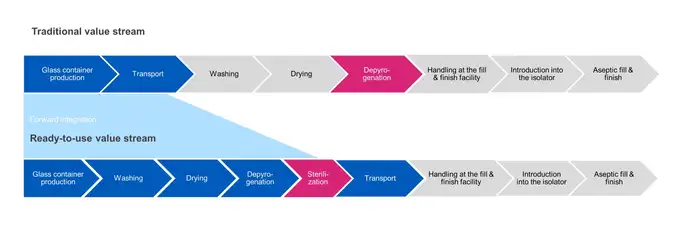
No envase de grande volume tradicional, a esterilização do recipiente é realizada na etapa de despirogenização. Os produtos são lavados, secados e passados por um túnel de calor para despirogenizá-los a temperaturas elevadas (280-350 °C) para garantir que sejam esterilizados antes de serem transferidos diretamente para a operação de envase.
Por outro lado, a esterilização de recipientes RTU é realizada após a embalagem final e antes do transporte até a instalação de envase asséptico e acabamento. Nas etapas subsequentes do processo, a embalagem externa é removida e a embalagem interna vedada é assepticamente transferida para a operação de envase. Existem desafios para garantir que a esterilidade seja mantida entre o ponto de saída da câmara de esterilização até o ponto de entrada em um isolador asséptico.
De forma resumida, a esterilidade tem tudo a ver com probabilidades, em que o risco de organismos sobreviventes em um objeto deve ser minimizado por processos validados e soluções de embalagem qualificadas. Para a embalagem RTU, a esterilidade precisa ser garantida desde o ponto de esterilização até atingir o isolador asséptico.
Nas próximas semanas, veremos mais detalhes sobre como evitar a contaminação e garantir a esterilidade completa para a embalagem primária RTU.
Embalagem primária RTU da SCHOTT Pharma
O SCHOTT iQ® é uma plataforma holística para padronizar componentes de embalagens prontas para uso (RTU) e melhorar a qualidade dos recipientes RTU. Com a SCHOTT iQ®, o desenvolvimento e a administração de medicamentos injetáveis de alta qualidade tornam-se eficientes e aumentam significativamente a segurança dos pacientes.
As variantes disponíveis na plataforma SCHOTT iQ® são adaptiQ®, syriQ® and cartriQ®, que são todas embaladas em containers padronizados.

Dr. Robert Lindner
Product Manager Bulk & Sterile Solutions
Cadastre-se para receber as últimas notícias
Mantenha-se atualizado com as informações sobre os produtos e serviços da SCHOTT Pharma e cadastre-se para receber nosso boletim informativo.