Auswirkungen der Umstellung von mRNA-Impfstoffen gegen Covid-19 von Fläschchen auf vorfüllbare Spritzen
Ungeachtet neuer Varianten wird sich die Coronapandemie unweigerlich zu einer endemischen Situation entwickeln. In vielen westlichen Ländern sind inzwischen 70–90 % der Bevölkerung geimpft – eine beispiellose Leistung, die ohne Massenimpfzentren nicht möglich gewesen wäre. Als idealer Behälter für den Impfstoff erwies sich das Mehrdosenfläschchen, das eine schnelle Markteinführung ermöglicht und durch umfangreiche Erfahrung bei der Abfüllung und Veredelung sowie durch regulatorisches Know-how unterstützt wird.
Von der Pandemie zur Endemie
Wenn die Krankheit die endemische Phase erreicht, besteht die Kontrolle in regelmäßigen Auffrischungsimpfungen, insbesondere bei Risikopatienten. Dies geschieht höchstwahrscheinlich in lokalen Gesundheitseinrichtungen, in denen das aktuelle Mehrdosenfläschchen möglicherweise nicht die effizienteste Lösung ist. Denn sobald das Fläschchen geöffnet wird, ist die Haltbarkeit des Impfstoffs eine Frage von Stunden und ungenutzte Dosen müssen entsorgt werden.
Die Umstellung von einem Mehrfachdosen- auf ein Einzeldosisfläschchen oder eine vorfüllbare Spritze (PFS) aus Polymer oder Glas würde die Benutzerfreundlichkeit verbessern und die Abfallmenge verringern, es gibt jedoch noch viele Fragen, die beantwortet werden müssen. Eine PFS ist ein komplexes Produkt mit mehreren Komponenten, die alle durch die Anforderungen des Lufttransports bei reduziertem Luftdruck sowie durch Einfrier-/Auftauzyklen und die für mRNA-Impfstoffe erforderliche Lagerung bei extrem niedrigen Temperaturen beeinträchtigt werden könnten.
SCHOTT Pharma hat daher ein ausgeklügeltes Testprogramm mit 1 ml/1 g SCHOTT TOPPAC® Spritzen aus Cyclic Olefin Copolymer (COC) entwickelt, das eine Reihe von Variablen einführt, um die entscheidenden Parameter besser zu verstehen. Die Spritzen wurden entweder mit Wasser für Injektionszwecke (WFI) oder mit Saccharose-Placebo gefüllt und ein oder zwei Zyklen lang bei -20 °C, -50 °C und -80 °C eingefroren. Es wurden drei verschiedene Kolben verwendet: Standard-Halobutyl Gummi, ein teilbeschichteter Kolben und ein beschichteter Kolben, der für die Gleitkräfte optimiert ist. Die Füllvolumina betrugen 0,25 ml, 0,5 ml, 0,75 ml und 1 ml, und der Verschlussabstand betrug 2 mm, 4 mm oder 6 mm. Die Spritzen wurden sowohl dem normalen atmosphärischen Druck als auch der Lufttransportsimulation ausgesetzt.
Kolbenbewegung
Die erste Frage betrifft die Auswirkungen auf die Sterilbarriere, die durch übermäßige Kolbenbewegungen verletzt werden kann. Drei Faktoren haben Einfluss auf die Kolbenbewegung: die Größe des Verschlussabstands, das Füllvolumen und der Kolbentyp. Es wurden verschiedene Gefriertemperaturen und Füllmedien getestet, aber es wurde kein Unterschied festgestellt.
Die Kolbenbewegung ist während der Transportsimulation (Niederdruck) immer am kritischsten, aber durch die Wahl des richtigen Kolbentyps und die Optimierung des Füll- und Veredelungsprozesses kann kontrolliert und sichergestellt werden, dass die Sterilbarriere nicht durchbrochen wird.
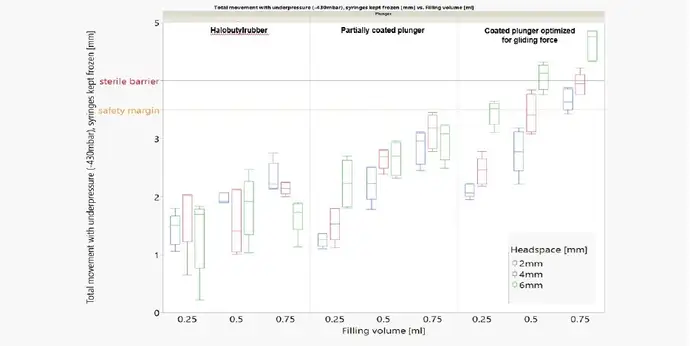
Leistungsvergleich von Spritzen mit einem Standardkolben aus Halobutylkautschuk, einem teilbeschichteten Kolben und einem beschichteten Kolben
Funktionalität
Die nächste Herausforderung ist die Funktionalität, insbesondere die Auswirkungen auf die Losbrechkraft (break loose force - BLF) und die Gleitkräfte (gliding forces - GF) unterschiedlicher Temperaturen über mehrere Gefrier-/Tauzyklen hinweg. Während drei Gefrier-/Auftauzyklen gab es keinen signifikanten Unterschied zwischen leeren und gefüllten Spritzen.
SCHOTT Pharma ging noch einen Schritt weiter und untersuchte eine noch niedrigere Temperatur von -50 °C mit drei verschiedenen Kolbentypen: Halobutyl Gummi, teilbeschichteter und beschichteter Kolben, optimiert für Gleitkraft. Auch hier gab es bei Gleitkraft und Losbrechkraft fast keinen Unterschied zwischen -20 °C und -80 °C.
Silikonisierung
Eine weitere Herausforderung ist die Silikonisierung. Spritzen brauchen eine Schmierschicht im Inneren des Zylinders, um die Bewegung des Kolbens zu ermöglichen. Zu viel freies Silikonöl kann jedoch Tröpfchen in der Spritze bilden, die mit dem Medikament reagieren und es instabil machen können.
SCHOTT Pharma testete zwei verschiedene Silikonisierungstechnologien auf SCHOTT TOPPAC® Spritzen: die vernetzte Silikonisierung, die bei SCHOTT TOPPAC® Standard ist, und die Aufsprühsilikonisierung. Fünf Spritzen für jede Technologie wurden mit WFI gefüllt und bei verschiedenen Temperaturen gelagert / eingefroren, bevor der Extrakt gepoolt und mittels Graphitrohr-Atomabsorption auf freies Silikonöl untersucht wurde.
Bei -5 °C und -20 °C war bei einer Aufsprühsilikonisierung im Vergleich zu einer vernetzten Silikonisierung die Menge des extrahierbaren Silikons um ein vielfaches höher: fünfmal bzw. 24 Mal höher. Dies zeigte, dass Gefrier-/Auftauzyklen einen signifikanten Einfluss auf aufgesprühte Silikonöl-Spritzen haben.
Die Silikonisierungstechnologie hat bei Gefriertemperaturen einen noch größeren Einfluss auf nicht sichtbare Partikel (>10 µm), wobei niedrigere Temperaturen die Partikelbelastung zu erhöhen scheinen.
Ebenso hat die Silikonisierungstechnologie einen erheblichen Einfluss auf die Partikelanzahl, wobei die immobilisierte Silikonschicht aus der vernetzten Silikonisierung den geringsten Partikelanteil aufweist. Silikonfreie Spritzen wiesen unter den gleichen Bedingungen keine Partikel auf. Es besteht also eine hohe Wahrscheinlichkeit, dass alle beobachteten nicht sichtbaren Partikel von der Silikonisierung stammen.
Container Closure Integrity
Die Container Closure Integrität von Behältern/Verschlüssen kann auch durch extrem niedrige Temperaturen wie -80 °C beeinträchtigt werden, was auf einen Elastizitätsverlust der Gummikomponenten und die unterschiedlichen Schrumpfungsraten der verschiedenen Materialien zurückzuführen ist. Es ist zum Beispiel nicht ungewöhnlich, dass der Spritzenzylinder viel weniger schrumpft als der Kolben, was zu einer minimalen Überlappung und einem Bruch der Barriere gegen das Eindringen von Biologika führen kann.
Die Tests wurden an SCHOTT TOPPAC® 1 ml/1 g Spritzen mit Standard-Halobutylgummikomponenten für Spitzenverschluss und Kolben durchgeführt und mit einer Reihe von Kontrollproben verglichen. Die Ergebnisse zeigten, dass selbst bei -80 °C nach 24 Stunden noch kein CO² eingedrungen war.
Auch die mechanische Stabilität und die optischen Eigenschaften wurden durch die Lagerung bei sehr niedrigen Temperaturen nicht beeinträchtigt, und es kam zu keiner Zunahme von Brüchen oder Spannungsrissen, Trübungen oder zusätzlichen optischen Mängeln.

Die ideale Lösung
SCHOTT Pharma untersucht weiterhin Produkt- und Prozessvariablen, um mRNA-Hersteller bei der Suche nach der idealen Primärverpackung zu unterstützen. Dazu gehören potenzielle Medikamentenbehälter-Wechselwirkungen, die aus extrahierbaren und auslaugbaren Stoffen aus dem Behälter resultieren, sowie die Auswirkungen des Behälters und der Lagerungsbedingungen auf die Stabilität der Lipidnanopartikel, die als Träger verwendet werden. Ein ähnliches Datenpaket stellt das Unternehmen auch für vorfüllbare syriQ® Glasspritzen zusammen.
Inzwischen zeigt dieses umfangreiche Datenpaket, dass SCHOTT TOPPAC® Spritzen optimal für mRNA-Impfstoffe geeignet sind.

Christoph Zauner
Head of Product Management Polymer Solutions
Melden Sie sich für die neuesten Nachrichten an
Bleiben Sie über SCHOTT Pharma Produkte und Services auf dem Laufenden und melden Sie sich für unseren Newsletter an.