
So erreichen Sie Sterilität in pharmazeutischen ready-to-use packaging
Injizierbare Medikamente umgehen unsere natürlichen Infektionsbarrieren, z. B. unsere Haut. Daher ist es für pharmazeutische Unternehmen unerlässlich, ein streng kontrolliertes und reguliertes Sterilitätsniveau für ihre Produkte sicherzustellen. Um dieses geforderte Niveau zu erreichen, werden je nach Eigenschaften des Produktes unterschiedliche Technologien eingesetzt. Sterilisationstechniken lassen sich in zwei große, aber klar unterschiedliche Bereiche unterteilen: physikalisch und chemisch, je nach Art des Sterilisationsmittels. Die einzelnen Technologien sind zwar bekannt, doch es gibt Vor- und Nachteile für alle, die sie für den Einsatz in speziellen Anwendungen im ready-to-use (RTU) Pharmaverpackungssektor mehr oder weniger geeignet machen.
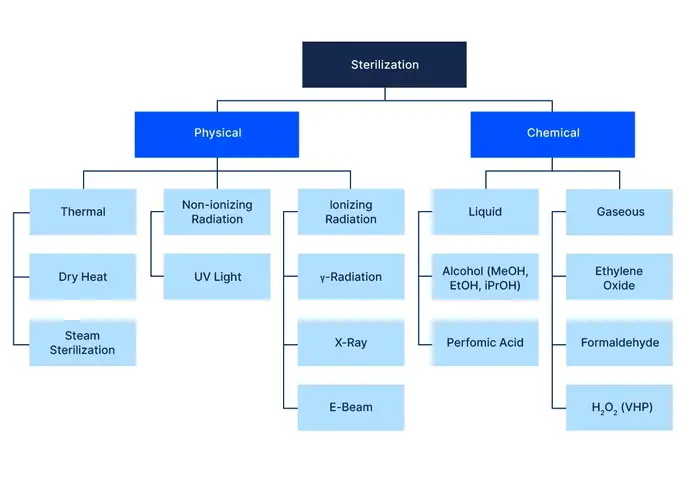
Die Familie der Sterilisationstechniken
Aus Umwelt- und Sicherheitssicht bietet die Dampfsterilisation viele Vorteile: Die Rückstände sind reines Wasser und im Vergleich zu einigen chemischen Technologien ist sie relativ einfach zu handhaben. Sie gilt für einige Anwendungen als hochmodern, darunter die ready-to-use cartriQ® Karpulen von SCHOTT.
Für einige Primär- und Sekundärverpackungsbehälter, z. B. Glas- und Polymerspritzen besteht bei Hitzeeinwirkung die Gefahr, dass einige Komponenten, wie Kunststoffteile oder Nadelkleber, die mechanische Stabilität und Dimensionsstabilität bzw. die Nadelauszugskraft beeinträchtigen. Daher sollte die Eignung der Dampfsterilisation von Fall zu Fall für die zu sterilisierenden Güter, z. B. Spritzen, überprüft werden.
Strahlensterilisation
Ionisierende und nichtionisierende Strahlung sind die anderen wichtigsten physikalischen Mittel der Sterilisation. Nicht ionisierendes UV-Licht hat eine sehr kleine Wellenlänge und seine hohe Energie zerstört koloniebildende Einheiten (cfus) durch das Spalten chemischer Bindungen. Doch obwohl UV-Lichtquellen reichlich vorhanden sind und die Technologie einfach zu implementieren ist, bietet UV-Licht wenig bis gar keine Durchdringung und wird daher hauptsächlich für die Dekontamination von Oberflächen verwendet, insbesondere vor dem Eintritt in einen aseptischen Isolator. Seine geringe Durchdringung macht es außerdem anfällig für Abschattungen, was bedeutet, dass es unwirksam auf nicht direkt exponierten Oberflächen ist. Daher ist eine komplexere Mechanik erforderlich, um sicherzustellen, dass die gesamte Oberfläche eines Objekts einer ausreichend hohen Dosis ausgesetzt wurde. Abhängig von den verwendeten Materialien und der Dosis, der sie ausgesetzt sind, können die Materialien schneller altern. Typische Werte, die bei der Dekontamination von Oberflächen verwendet werden, sind jedoch so niedrig, dass die Auswirkungen auf die Materialeigenschaften nicht signifikant sind.
Ionisierende Strahlungsformen werden häufiger verwendet als nichtionisierende Strahlung. Gammastrahlung bietet eine hohe Durchlässigkeit, ist kostengünstig und hinterlässt keine Rückstände, die schädliche Nebenwirkungen verursachen könnten. Der Nachteil ist jedoch, dass klares Borosilikatglas eine bräunliche Farbe annimmt, ein Phänomen, das als Solarisation bezeichnet wird. Dies erschwert die optische Inspektion nach der Abfüllung und macht es schwieriger, Partikel im fertigen Produkt zu erkennen. Es kann jedoch für Polymerbehälter verwendet werden, bei denen die Solarisation nicht so stark ist.
Die Elektronenstrahlbestrahlung wird in der Fill-and-Finish-Industrie am häufigsten eingesetzt. Die Durchlässigkeit ist geringer als bei Gammastrahlung, aber höher als bei UV-Licht und hinterlässt auch keine Rückstände. Aufgrund seiner mittleren Durchdringung wird es hauptsächlich für Produkte mit geringer Dichte verwendet. Wie bei Gammastrahlung führt es zur Solarisation in Borosilikatglas und bei hohen Dosen zur Versprödung von Polymeren in Sekundärverpackungen. Ein großer Vorteil von Elektronenstrahlen ist, dass im Gegensatz zu Gammastrahlung die Strahlungsabgabe bei Bedarf ein- und ausgeschaltet werden kann. Dies verbessert die Strahlensicherheit beim Umgang mit solchen Geräten erheblich. Aufgrund der unerwünschten Solarisation und des günstigen Sicherheitsprofils werden Elektronenstrahl-Quellen in der Regel für die Oberflächendekontamination mit kurzen Expositionszeiten verwendet.
Chemische Sterilisation
Chemische Sterilisationstechniken werden auch in der Industrie regelmäßig eingesetzt, da sie bei niedrigeren Temperaturen, d. h. 28–40 °C, aktiv sind, im Gegensatz zu Dampf oder trockener Hitze. Die niedrigere Temperatur bietet eine ausgezeichnete Materialverträglichkeit. Das Sterilisationsmittel muss jedoch jede Oberfläche der Objekte erreichen, um einen SAL von 10-6 gemäß ISO 14937 zu erreichen und zu gewährleisten. Bei gasförmigen Sterilisationsmitteln wie Wasserstoffperoxid (H2O2) oder Ethylenoxid (EtO) bedeutet dies, dass die Sterilisation unter Vakuum durchgeführt werden muss, typischerweise 1 – 10 mbar.
Gasförmiges Wasserstoffperoxid hat eine starke Oxidationskraft und reagiert schnell mit organischen Materialien, wodurch Mikroorganismen inaktiviert werden. Wie bei anderen gasförmigen Sterilisationszyklen können Rückstände ein Problem darstellen. *Fill-and-Finish-Prozess Die Menge an Rückständen hängen direkt von den Prozessparametern ab, z. B. Gaskonzentration und Belüftungszeit.
Am häufigsten wird die Sterilisation von Ready-to-Use (RTU)-Packmitteln mit Ethylenoxid (EtO) durchgeführt. Während dEtO sehr sorgfältig gehandhabt werden muss, machen seine Eigenschaften es zu einem sehr wirkungsvollen Sterilisationsmittel. EtO ist eine anerkannte Standard-Sterilisationstechnik in der Pharmaindustrie, und für viele Produkte wie die syriQ® Spritzen von SCHOTT und adaptiQ® RTU-Fläschchen gibt es keine praktikable Alternative. Es gibt Leitlinien und Standards, die EtO-Sterilisationsprozesse und die zulässige Menge an EtO-Rückständen in einem Medizinprodukt regeln: ISO 11135-1: Sterilisation von Medizinprodukten und ISO 11993–7: EtO Rückstände. Alle in syriQ® und adaptiQ® verwendeten Materialien wurden so ausgewählt, dass sie mit der EtO-Sterilisation kompatibel sind. Die jeweiligen Sterilisationszyklen wurden so konzipiert und validiert, dass ein SAL von 10-6 mit minimalen Restmengen bei gleichzeitiger Reduzierung des EtO-Bedarfs erreicht und somit die ökologischen Auswirkungen reduziert werden.

Dr. Robert Lindner
Product Manager Bulk & Sterile Solutions
Melden Sie sich für die neuesten Nachrichten an
Bleiben Sie mit Informationen über SCHOTT Pharma Produkte und Services auf dem Laufenden und melden Sie sich für unseren Newsletter an.